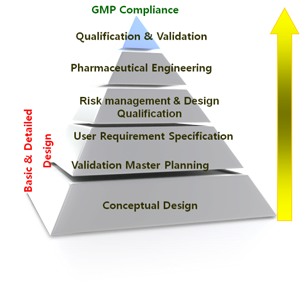
 바이오써포트는 2004년에 신축 GMP제조소에 대한 종합컨설팅을 최초로 시작하여 내용고형제, 내용액제, 주사제, 연고제, 항암제, 원료의약품(합성, 발효, 추출), 생물의약품, 세포치료제, 유전자치료제, 건강기능식품, 의료기기 등의 GMP제조소 구축을 위한 종합컨설팅을 수행하고 있습니다. 신축 GMP 제조소 구축을 위한 프로세스는 다음과 같이 추진합니다.
바이오써포트는 2004년에 신축 GMP제조소에 대한 종합컨설팅을 최초로 시작하여 내용고형제, 내용액제, 주사제, 연고제, 항암제, 원료의약품(합성, 발효, 추출), 생물의약품, 세포치료제, 유전자치료제, 건강기능식품, 의료기기 등의 GMP제조소 구축을 위한 종합컨설팅을 수행하고 있습니다. 신축 GMP 제조소 구축을 위한 프로세스는 다음과 같이 추진합니다.

Validation Strategy Execution Service
밸리데이션 시작되면, 밸리데이션 전략을 수립하고 이를 문서화하여야 합니다.
이 밸리데이션 전략에는 밸리데이션에 대한 책임과 권한, 밸리데이션 방침, 실시대상, 일탈관리, 변경관리 등이 포함되어야 하며, 이 밸리데이션 전략과 관련하여 다음과 같은 컨설팅을 수행합니다(밸리데이션 전략 수립은 밸리데이션 종합계획 수립 및 문서화를 말함).
- Validation Master Planning & Documentation
- Validation Working Party
- Documentation and Change Control of Validation Regulation and Reference
- Qualification Master Planning & Documentation
- System/Quality Impact Assessment
- Validation Time Scheduling
- Document Development for Validation Management System
- ◆ Document Control Procedures for Validation
- ◆ Qualification and Validation Procedures
- ◆ Change Control Procedures for Validation
- ◆ CAPA Procedures for Validation
- ◆ Related SOPs Development
|
 |
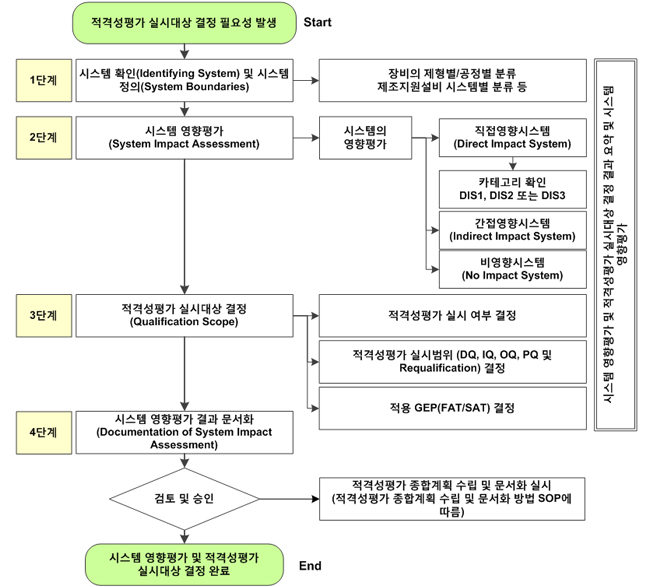
밸리데이션 전략 시에 중요한 프로세스 중 하나가 적격성평가 실시대상을 결정하는 것입니다. 당사에서는 다음의 프로세스(System/Quality Impact Assessment)에 따라 적격성평가 실시대상을 결정하고 문서화합니다.
Qualification Solution & Consulting Service
|
생산장비, 분석장비, 제조지원설비 등에 대한 적격성평가 시험 서비스 항목은 다음과 같습니다.
- QRM 기반 URS Development
- Basic/ Detail Design Enhanced Review
- Qualification Strategy & Planning
(New / In-use Equipment and System) ~~ Qualification Plan(QP) Documentation
- Design Risk Assessment(QRM)
- Design Qualification Protocol, Execution and Report ~~ RTM(Requirement Tracking Matrix) Documnatation
- Installation Qualification Protocol, Execution and Report
- Operational Qualification Protocol, Execution and Report
- Performance Qualification Protocol, Execution and Report
- Environmental Monitoring Prorgam Consulting and EM Execution Service
- Qualification Summary Report(QSR) Documentation
- Requalification Protocol, Execution and Report
|
 |
Your True, Reliable Qualification Partner
- Qualification of Utility System : Water & Steam System / HVAC System / Process Air System etc
- Qualification of Manufacturing Equipment :
Oral Solid Dosage Form / Injections / Ointments / Liquids / API / Biopharmaceuticals / Cell & Gene Therapy
- Qualification of QC Equipment
- Qualification of Warehouse(Thermal Validation)
바이오써포트는 적격성평가를 글로벌 기준과 표준에 따라 실시합니다. 예들 들면, 고압증기멸균기(Autoclave)의 적격성평가는 다음의 자료를 근거로 실시합니다.
 |
- PDA Technical Report No. 1 - Revised 2007
- Validation of Moist Heat Sterilization Processes:
- Cycle Design, Development, Qualification and Ongoing Control
|
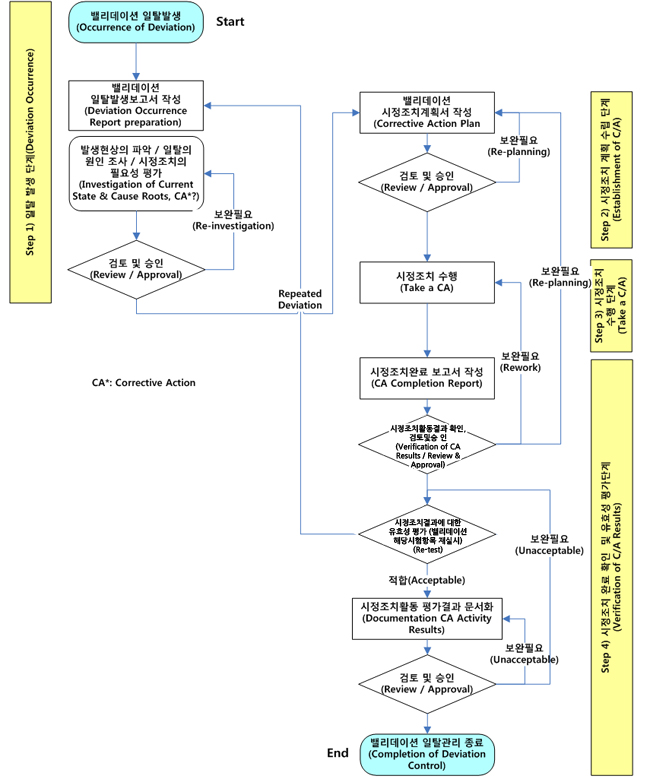
바이오써포트는 적격성평가에서 발생하는 일탈에 대하여 다음의 일탈관리에 대한 Process Map에 따라 강력하고 철저하게 일탈관리를 실시합니다.
Cleaning and Process Validation Consulting Service
바이오써포트는 QbD 및 위험을 기반으로 한 세척 및 공정밸리데이션 컨설팅을 실시하고 있으며,
해당 컨설팅 항목은 다음과 같습니다.
- Production Process Quality Risk Management(QRM)
- Cleaning Process Quality Risk Management(QRM)
- Aseptic Process Quality Risk Management(QRM)
- Cleaning Validation Master Plan(CVMP)
- Process Validation Master Plan(PVMP)
- Cleaning Validation Protocol Development
- Process Validation Protocol Development
- Aseptic Process Validation Consulting
- Aseptic Gowning Process Validation Consulting
- Bio-Pharmaceutical Process Validation Consulting
- Disinfectant Efficay Validation Consulting
- Bioburden Test Method Validation Consulting
- Revalidation Consulting
- Process & Cleaning Validation Training
- Related SOPs Development(Optional)
|
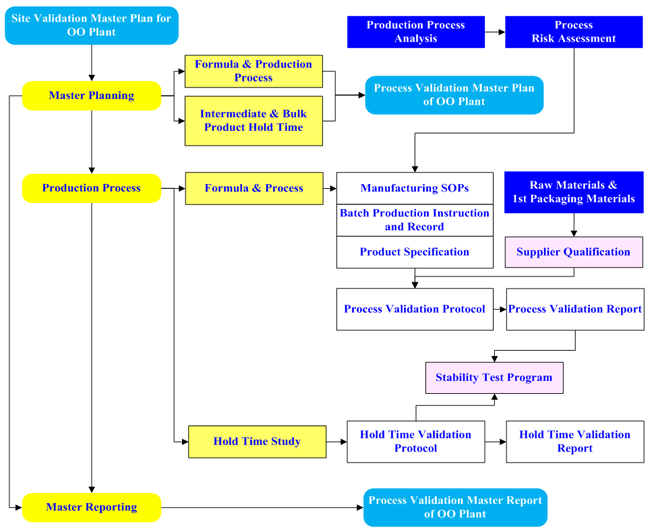
 |
[Process Validation Process Map]
 Validation Technology
Validation Technology
 적격성평가 및 밸리데이션 기술
적격성평가 및 밸리데이션 기술 Validation Technology
Validation Technology
 적격성평가 및 밸리데이션 기술
적격성평가 및 밸리데이션 기술